2×Taq Platinum PCR Mix
Definizione di attività
1 unità (U) Taq Platinum DNA Polimerasi L'attività è definita come la quantità di enzima necessaria per incorporare 10 nmol di deossinucleotidi in sostanze insolubili in acido a 74°C entro 30 min utilizzando DNA spermatico di salmone attivato come stampo/primer.
Controllo di qualità
La purezza mediante rilevamento SDS-PAGE è superiore al 99%; Non viene rilevata alcuna attività della nucleasi esogena; Il gene a copia singola nel genoma umano potrebbe essere amplificato in modo efficace; Nessun cambiamento significativo di attività se conservato a temperatura ambiente per una settimana.
Parametri tecnici principali
Ha attività esonucleasica 5'-3' e attività esonucleasica 3'-5' e la sua fedeltà è accanto alla polimerasi Pfu. La velocità di estensione della Taq Platinum Polymerase è più veloce della Pfu polimerasi e l'efficienza di amplificazione è maggiore. I prodotti della PCR possono essere direttamente legati all'estremità smussata o clonati con il vettore TA. Se l'efficienza della clonazione deve essere migliorata, si consiglia di purificare prima e aggiungere sporgenze 3'-dA prima della clonazione nel vettore TA.
Taq Platinum MasterMix a un tubo (certificazione nazionale del prodotto High-Tech)
■ Il Taq Platinum MasterMix ha migliorato la specificità e la sensibilità della reazione PCR e può amplificare modelli complessi con un alto contenuto di GC, struttura secondaria e simili. È possibile amplificare fino a 2 copie del modello target, garantendo risultati sperimentali più accurati.
■ L'esclusiva formula Taq Platinum MasterMix rende l'intero sistema di reazione molto stabile e l'attività non sarà influenzata da ripetuti congelamento-scongelamento o conservazione a lungo termine a 4°C.
■ La soluzione mista PCR pre-preparata stabile ed efficiente può rendere l'operazione rapida e semplice, riducendo notevolmente l'intensità del lavoro e l'errore di campionamento. Nella miscela sono inclusi anche un potenziatore e un ottimizzatore della PCR ad alte prestazioni, il che riduce i requisiti sulle condizioni della PCR.
■ Questo prodotto dispone di sistemi sia contenenti coloranti che privi di coloranti. I prodotti MasterMix contenenti coloranti possono essere sottoposti a elettroforesi direttamente dopo la PCR, senza aggiungere buffer di caricamento.
Applicazioni
Può sostituire la polimerasi Pfu per amplificare prodotti ad alta fedeltà da modelli complessi come genomi ed è adatto per applicazioni come la clonazione di geni di espressione, mutazioni site-specific e analisi del polimorfismo a singolo nucleotide (SNP), ecc.
Precauzioni nella progettazione di primer per PCR:
La lunghezza del primer è solitamente di 20-25 mer. Tuttavia, quando si esegue la PCR a frammenti lunghi, la lunghezza del primer deve essere aumentata a 30-35 mer.
■ Non c'è accoppiamento complementare tra i due primer, specialmente per le ultime 3 basi all'estremità 3′.
■ Il contenuto di GC dovrebbe essere del 50-60% ed evitare GC o AT ricchi locali. Per fare in modo che primer e stampo si leghino stabilmente, evitare la struttura ricca di AT all'estremità 3'.
■ Evitare che il primer formi una struttura secondaria.
■ Selezionare due primer con temperature Tm vicine l'una all'altra.
Calcolo del valore Tm dei primer per PCR:
■ Quando il primer è inferiore a 20 mer: Tm=2°C×(A+T)+4°C×(G+C).
■ Quando il primer è superiore a 20 mer: Tm=81,5+0,41×(GC%)-600/L, dove L è la lunghezza del primer.
■ Impostare la temperatura di ricottura a (Tm-5)°C.
Ingresso primer PCR
La concentrazione finale appropriata di primer può essere selezionata tra 0,1 μM e 1,0 μM. Una concentrazione di primer troppo bassa porta a una bassa resa dei prodotti di amplificazione, mentre una concentrazione di primer troppo alta è più soggetta ad amplificazione non specifica. Di solito, quando la quantità di DNA stampo è grande o il DNA stampo complesso (come il DNA del genoma umano) viene utilizzato come stampo, la concentrazione di primer dovrebbe essere inferiore. Quando la quantità di DNA stampo è piccola o il DNA stampo semplice (ad es. DNA plasmidico, ecc.) viene utilizzato come stampo, la concentrazione di primer dovrebbe essere maggiore.
Tutti i prodotti possono essere personalizzati per ODM/OEM. Per dettagli,fare clic su Servizio personalizzato (ODM/OEM)
 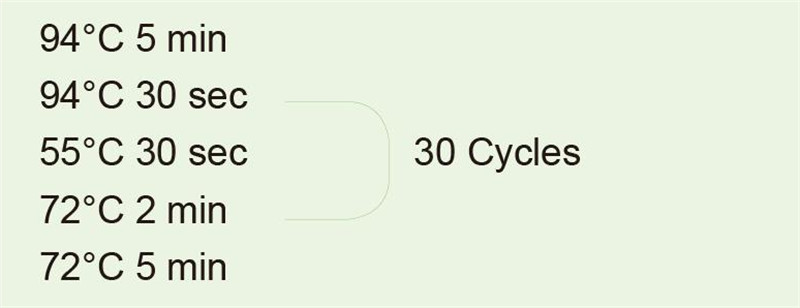 |
Utilizzare il DNA genomico come modello per amplificare il frammento di 1 kb. Dopo la reazione PCR, prelevare 5 μl per il rilevamento dell'elettroforesi. |
Modello A-1
■ Il modello contiene impurità proteiche o inibitori Taq, ecc. ——Purificare il modello di DNA, rimuovere le impurità proteiche o estrarre il DNA modello con i kit di purificazione.
■ La denaturazione del templato non è completa ——Aumentare opportunamente la temperatura di denaturazione e prolungare il tempo di denaturazione.
■ Degrado del modello ——Ripreparare il modello.
A-2 Primer
■ Scarsa qualità dei primer ——Risintetizzare il primer.
■ Degradazione del primer ——Aliquotare i primer ad alta concentrazione in un piccolo volume per la conservazione. Evitare il congelamento e lo scongelamento multiplo o la crioconservazione a lungo termine a 4°C.
■ Progettazione inadeguata dei primer (es. lunghezza del primer non sufficiente, dimero formato tra i primer, ecc.) - Riprogettazione dei primer (evitare la formazione di dimero di primer e struttura secondaria)
A-3 mg2+concentrazione
■ Mg2+ la concentrazione è troppo bassa ——Aumentare adeguatamente Mg2+ concentrazione: Ottimizza il Mg2+ concentrazione mediante una serie di reazioni da 1 mM a 3 mM con un intervallo di 0,5 mM per determinare il Mg . ottimale2+ concentrazione per ogni stampo e primer.
A-4 Temperatura di ricottura
■ L'elevata temperatura di ricottura influisce sul legame del primer e del modello. ——Ridurre la temperatura di ricottura e ottimizzare la condizione con un gradiente di 2°C.
A-5 Tempo di estensione
■ Tempo di estensione breve: aumenta il tempo di estensione.
Fenomeni: i campioni negativi mostrano anche le bande della sequenza bersaglio.
A-1 Contaminazione della PCR
■ Contaminazione incrociata della sequenza target o dei prodotti di amplificazione ——Fare attenzione a non pipettare il campione contenente la sequenza target nel campione negativo oa versarli fuori dalla provetta da centrifuga. I reagenti o l'attrezzatura devono essere sterilizzati in autoclave per eliminare gli acidi nucleici esistenti e l'esistenza di contaminazione deve essere determinata mediante esperimenti di controllo negativo.
■ Contaminazione dei reagenti ——Aliquotare i reagenti e conservarli a bassa temperatura.
A-2 Primor
■ Mg2+ la concentrazione è troppo bassa ——Aumentare adeguatamente Mg2+ concentrazione: Ottimizza il Mg2+ concentrazione mediante una serie di reazioni da 1 mM a 3 mM con un intervallo di 0,5 mM per determinare il Mg . ottimale2+ concentrazione per ogni stampo e primer.
■ Progettazione del primer non corretta e la sequenza target ha omologia con la sequenza non target. ——Riprogettazione dei primer.
Fenomeni: le bande di amplificazione della PCR non sono coerenti con le dimensioni previste, sia grandi che piccole, o talvolta si verificano sia bande di amplificazione specifiche che bande di amplificazione non specifiche.
A-1 Primer
■ Scarsa specificità del primer
——Riprogettazione del primer.
■ La concentrazione di primer è troppo alta ——Aumentare adeguatamente la temperatura di denaturazione e prolungare il tempo di denaturazione.
A-2 mg2+ concentrazione
■ Il Mg2+ la concentrazione è troppo alta ——Ridurre adeguatamente la concentrazione di Mg2+: ottimizzare il Mg2+ concentrazione mediante una serie di reazioni da 1 mM a 3 mM con un intervallo di 0,5 mM per determinare il Mg . ottimale2+ concentrazione per ogni stampo e primer.
A-3 Polimerasi termostabile
■ Quantità eccessiva di enzima ——Ridurre la quantità di enzima in modo appropriato a intervalli di 0,5 U.
A-4 Temperatura di ricottura
■ La temperatura di ricottura è troppo bassa ——Aumentare opportunamente la temperatura di ricottura o adottare il metodo di ricottura a due fasi
A-5 cicli PCR
■ Troppi cicli PCR ——Ridurre il numero di cicli PCR.
A-1 Primer——Scarsa specificità ——Riprogettare il primer, modificare la posizione e la lunghezza del primer per migliorarne la specificità; o eseguire la PCR nidificata.
A-2 DNA modello
——Il modello non è puro ——Purificare il modello o estrarre il DNA con i kit di purificazione.
A-3 mg2+ concentrazione
——Mg2+ la concentrazione è troppo alta ——Ridurre adeguatamente Mg2+ concentrazione: Ottimizza il Mg2+ concentrazione mediante una serie di reazioni da 1 mM a 3 mM con un intervallo di 0,5 mM per determinare il Mg . ottimale2+ concentrazione per ogni stampo e primer.
A-4 dNTP
——La concentrazione di dNTP è troppo alta ——Ridurre adeguatamente la concentrazione di dNTP
A-5 Temperatura di ricottura
——Temperatura di ricottura troppo bassa ——Aumentare opportunamente la temperatura di ricottura
A-6 Cicli
——Troppi cicli ——Ottimizza il numero di cicli

Il primo passo è scegliere la polimerasi appropriata. La normale Taq polimerasi non può correggere le bozze a causa della mancanza di attività esonucleasica 3'-5' e la mancata corrispondenza ridurrà notevolmente l'efficienza di estensione dei frammenti. Pertanto, la normale Taq polimerasi non può amplificare efficacemente i frammenti bersaglio più grandi di 5 kb. La Taq polimerasi con modifica speciale o altra polimerasi ad alta fedeltà dovrebbe essere selezionata per migliorare l'efficienza dell'estensione e soddisfare le esigenze di amplificazione di frammenti lunghi. Inoltre, l'amplificazione di frammenti lunghi richiede anche la corrispondente regolazione del disegno del primer, del tempo di denaturazione, del tempo di estensione, del pH del tampone, ecc. Di solito, i primer con 18-24 bp possono portare a una resa migliore. Per evitare danni al templato, il tempo di denaturazione a 94 °C deve essere ridotto a 30 secondi o meno per ciclo e il tempo per aumentare la temperatura a 94 °C prima dell'amplificazione deve essere inferiore a 1 minuto. Inoltre, l'impostazione della temperatura di estensione a circa 68°C e la progettazione del tempo di estensione in base alla velocità di 1 kb/min possono garantire un'efficace amplificazione di frammenti lunghi.
Il tasso di errore dell'amplificazione PCR può essere ridotto utilizzando varie DNA polimerasi ad alta fedeltà. Tra tutte le Taq DNA polimerasi trovate finora, l'enzima Pfu ha il più basso tasso di errore e la più alta fedeltà (vedi tabella allegata). Oltre alla selezione degli enzimi, i ricercatori possono ridurre ulteriormente il tasso di mutazione della PCR ottimizzando le condizioni di reazione, compresa l'ottimizzazione della composizione del tampone, la concentrazione della polimerasi termostabile e l'ottimizzazione del numero del ciclo della PCR.
Categorie di prodotti
PERCHÉ SCEGLIERE NOI
Dalla sua istituzione, la nostra fabbrica ha sviluppato prodotti di prima classe mondiale con l'adesione al principio
di qualità prima di tutto. I nostri prodotti hanno guadagnato un'eccellente reputazione nel settore e preziosa fiducia tra i clienti vecchi e nuovi.








